外泌体(Exosome)是细胞经过“内吞-融合-外排”形成的一种直径在30-150纳米之间的圆形单层膜结构细胞外小囊泡。这些微小的囊泡可以携带多种生物活性分子,如蛋白质、核酸和脂质等,在细胞间进行物质运输和信息传递。它们不仅广泛参与了细胞生理活动的调控,还在多种生命活动中扮演着关键角色。因此,检测和分离具有特定功能的外泌体已经引起了广泛的关注。
在这个领域中,外泌体特异性识别元件的筛选和开发显得尤为重要。这些元件可以作为标签,帮助我们准确地识别和分离出具有特定功能的外泌体。例如,有些识别元件可以与某些特定疾病相关的外泌体结合,这样我们就可以通过这些元件的筛选来诊断和治疗这些疾病。这种技术的应用前景广阔,相信在未来会得到更加广泛的研究和应用。
近日,北京理工大学屈锋教授团队在外泌体囊泡的核酸适配体筛选方面取得了最新进展。他们提出了一种基于CE-SELEX的外泌体囊泡的核酸适配体筛选新策略,成功筛选到自然杀伤细胞外泌体囊泡的特异性核酸适配体。该方法对外泌体的样品消耗量少、筛选周期短、且筛选获得的核酸适配体具有良好的亲和力和特异性,为完整外泌体囊泡核酸适配体的筛选提供新方向。

核酸适配体作为 “化学抗体” 和新型识别分子在生物分离、传感检测、医学成像和药物研发中的应用日益增多。利用适配体对外泌体表面蛋白的特异性识别作用能够实现外泌体的分离和提取。基于CD63、MUC1或EpCAM等特异性蛋白适配体亲和方法已被应用于外泌体分离及提取研究,但适配体只能识别外泌体表面的特异性蛋白,其识别和捕捉效果的强弱取决于该蛋白在外泌体表面表达的含量。
对整个外泌体囊泡进行适配体的筛选,对于提高筛选的适配体的亲和力和特异性、发现和鉴定外泌体未知表面蛋白标记物具有重要意义。完整外泌体囊泡的适配体筛选是目前面临的技术难题。
毛细管电泳(Capillary electrophoresis, CE)作为一种微量分析技术,在囊泡类靶标的核酸适配体筛选中具有特殊优势:(1)无需引入固相介质:核酸与靶标的结合在自由溶液中进行,并能够实现靶标-核酸复合物的高效分离和精准收集;(2)多尺度靶标:可以实现小分子、蛋白、细胞、病毒、细菌等多尺度靶标的核酸适配体高效筛选;(3)多筛选模式:能够根据靶标特性选择筛选模式,制定筛选策略;(4)高筛选效率:可在一次CE过程中实现复合物的收集及亲和作用比较,且仅需1-4轮即可实现高特异性高亲和力核酸适配体筛选。
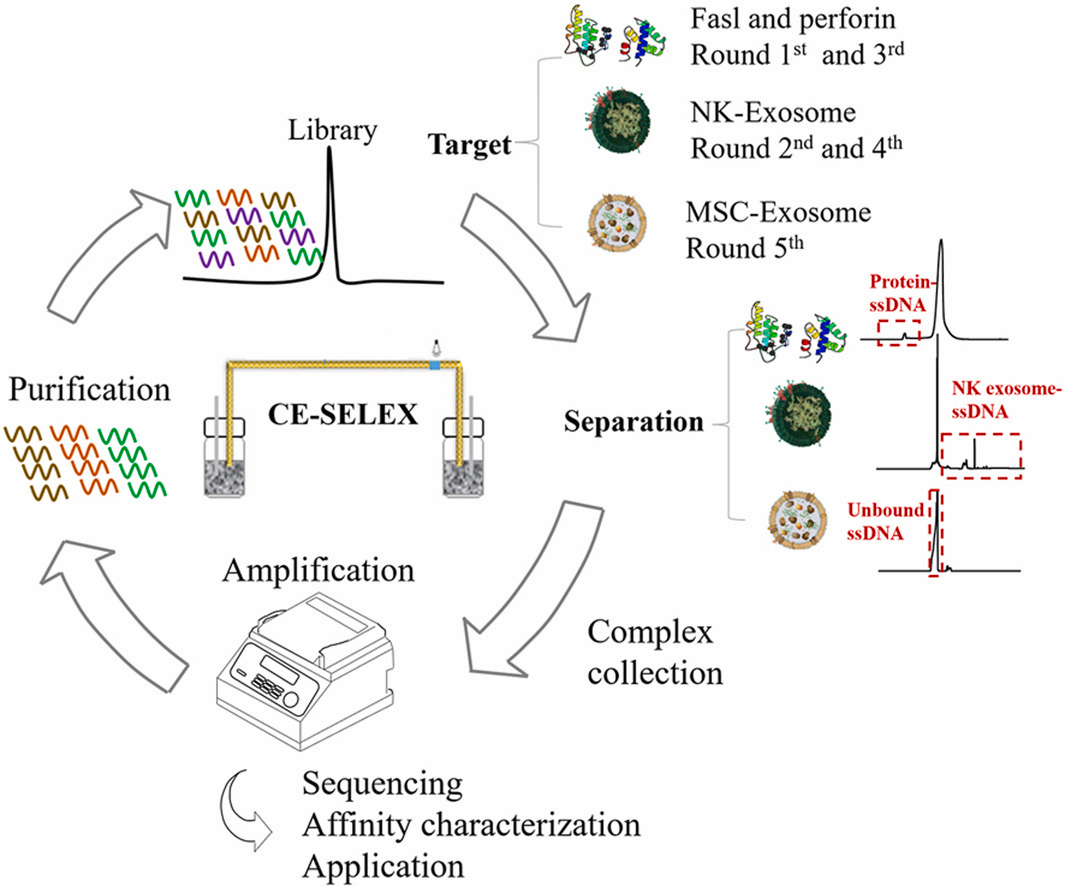
图片摘要,基于CE-SELEX的外泌体囊泡核酸适配体筛选过程
该团队首次提出了一种基于CE-SELEX的三步进化增强型筛选策略,用于外泌体囊泡的高效适配体筛选。以自然杀伤细胞(NK)外泌体为目标物:首先以NK细胞外泌体表面的特异性蛋白(PRFI、Fasl)为靶标,进行第一轮和第三轮筛选,实现精准核酸序列收敛;以NK细胞外泌体为靶标,进行第二轮和第四轮筛选,实现亲和力进化;以MSC外泌体为反筛靶标,实现特异性进化。采用此三步进化增强筛选策略,通过五轮筛选。获得的适配体具有良好的亲和力(KD为27.6 nM),和特异性(可以识别不同来源的外泌体)。
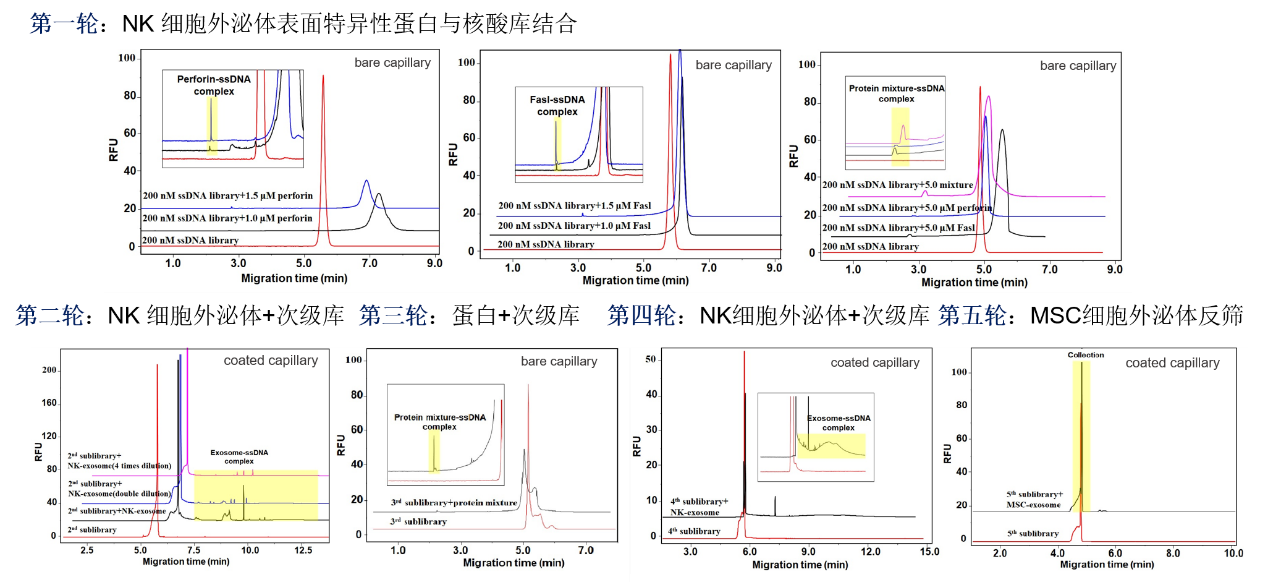
图1 基于CE-SELEX的三步进化增强型筛选策略
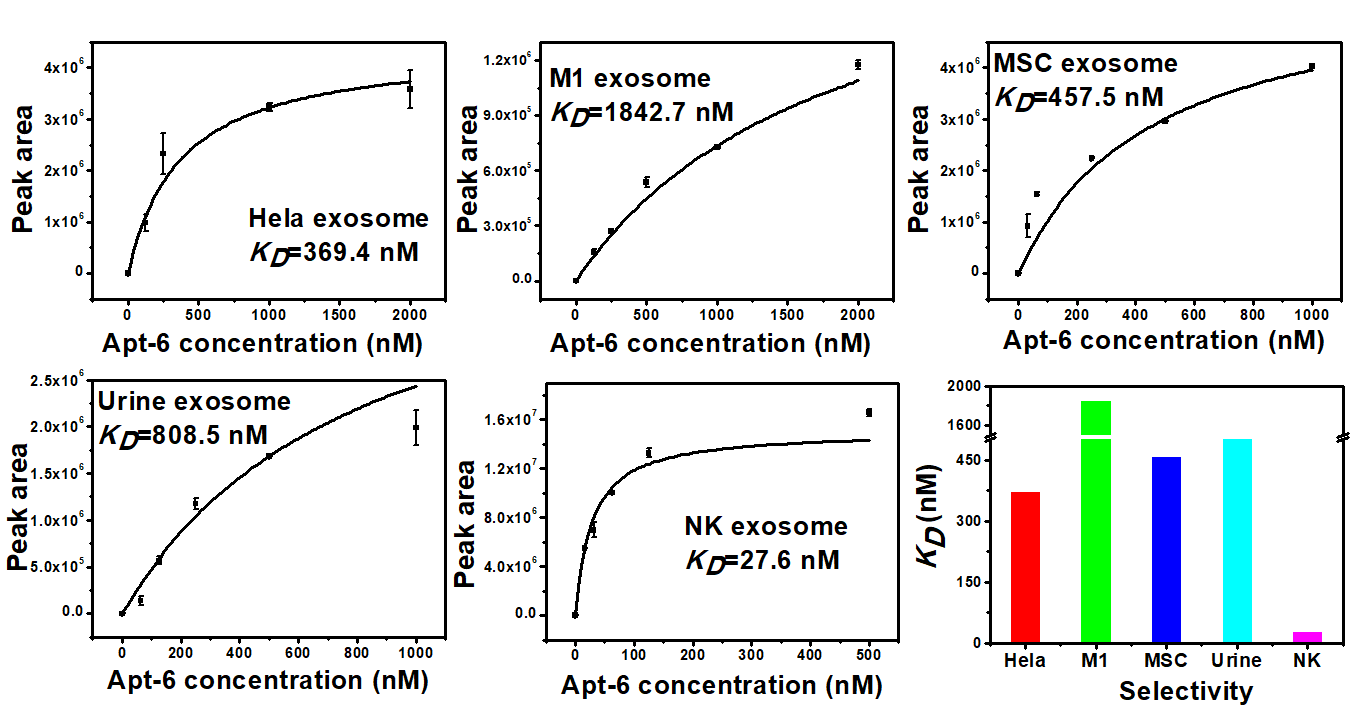
图2 核酸适配体对不同来源外泌体的特异性
参考文献:Three-step evolutionary enhanced capillary electrophoresis-SELEX for aptamer selection of exosome vesicles.Talanta, 2023 Sep 14:267:125203.