在医药领域,新药研发之路向来都是“九死一生”,而这其中药物递送环节是最重要的部分。作为连接药物开发与临床应用的桥梁,药物递送被誉为药物研发的“最后一公里”,如何能使有效成分在被不大量消解的情况下,安全地被输送到正确的位置,才开始发挥作用,是新药的关键。
药物在进入人体后,常常会被细胞外基质(ECM)这道复杂防线拦住去路。ECM 是由各种生物分子组成的复杂网络,其结构和成分的异质性,使得传统脂质纳米颗粒难以顺利穿透,导致药物无法均匀分布到组织中,不仅影响治疗效果,还可能增加药物的毒性。
近期,发表于ACS Nano的一项研究 Exosome-Inspired Lipid Nanoparticles for Enhanced Tissue Penetration 为解决上述难题带来了新的思路。韩国科学技术院团队设计了类外泌体囊泡(ELVs),灵感来自外泌体独特的运输现象。具体来说,将三种与运输相关的外泌体成分(阴离子脂质、胆固醇和水通道蛋白-1)整合到 ELVs 中,以模拟外泌体优于合成脂质纳米颗粒的扩散行为。

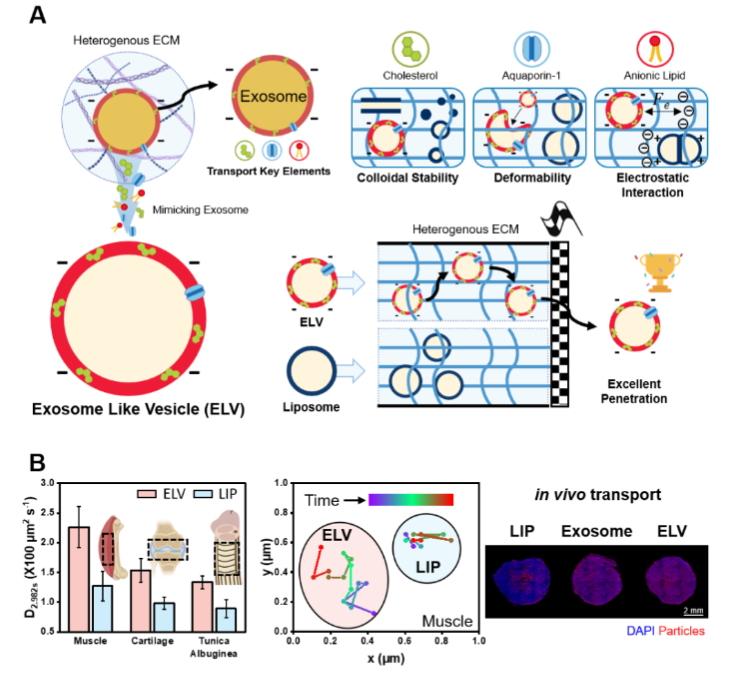
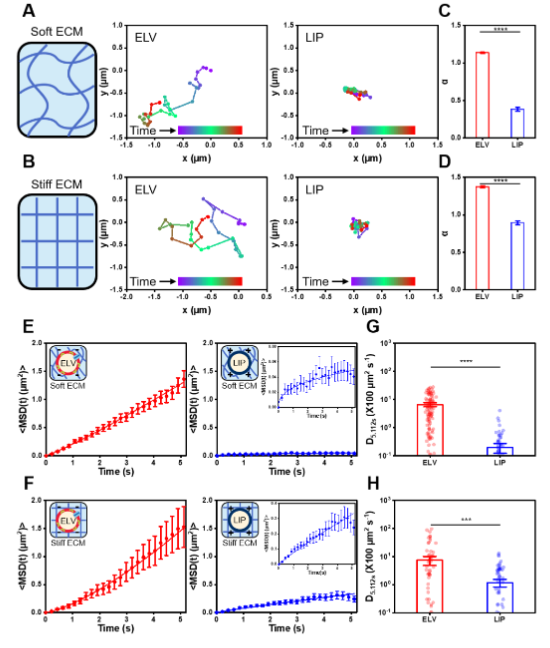
令人惊讶的是,体扩散和单颗粒扩散研究均表明,与传统脂质纳米颗粒相比,模型细胞外包装内的有效扩散系数增加了33倍以上。此外,ELVs 显示生物组织内的有效扩散系数增加了80%。ELVs 出色的运输行为在体内得到了进一步验证,其中肿瘤内注射展示了其出色的运输。这些发现为改善组织渗透性的脂质纳米颗粒设计提供了见解。
从结构层面来看,胆固醇的加入对 ELVs 产生了显著影响。当胆固醇融入 ELVs 的双层膜时,会促使脂质尾部伸展,形成有序液相,进而增加双层膜的厚度。这种厚度的增加使得 ELVs 的膜刚性增强,有效提高了其在 ECM 中的胶体稳定性,降低了聚集的风险。
科研人员将 ELVs 应用于乳腺癌小鼠模型。瘤内注射3小时后,大部分 LIPs 仍停留在注射部位,而 ELVs 却能够均匀地分布在整个肿瘤组织中。科研人员还将化疗药物阿霉素封装到 ELVs 中(DOX@ELVs),静脉注射到小鼠体内后发现,DOX@ELVs 能在1小时内大量聚集在肿瘤组织,并持续停留9小时,有效抑制了肿瘤的生长。
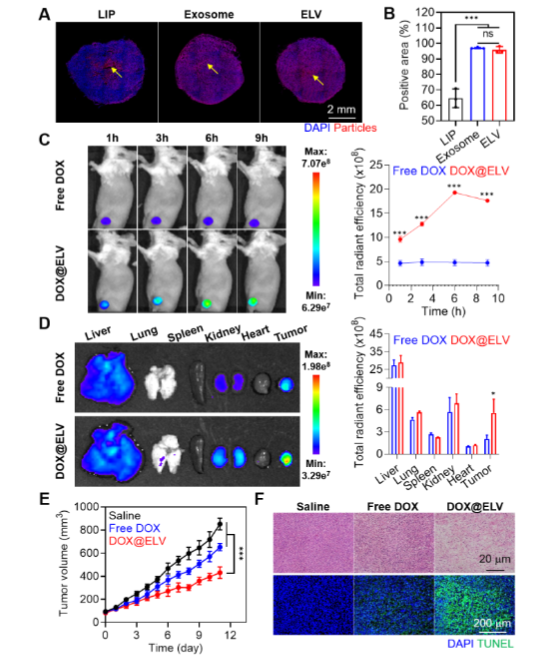
该研究提出了一种以外泌体启发的脂质纳米颗粒设计方法,以增强 ECM 渗透。将参与其运输的三种外泌体成分引入脂质纳米颗粒中以合成 ELVs。该研究表明,胆固醇、AQP1 和阴离子脂质为 ELVs 提供了胶体稳定性和可变形性。每个成分的作用是相关的,并且通过原位 SAXS 研究找到了 ELVs 的最佳组成。优化后的 ELVs 不仅在模型 ECM 中,而且在三种生物组织中都表现出出色的扩散性能,证明了 ELVs 策略的多功能性和有效性。
如需了解更多关于“肿瘤”信息
请与我们进一步联系







